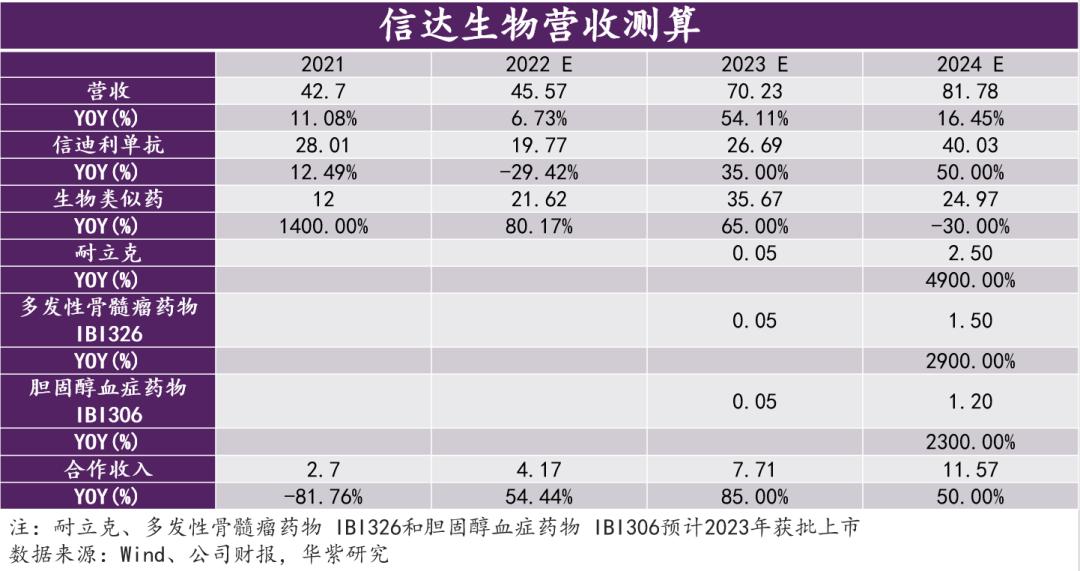
2024医保国谈启示:不乏年内上市新药,“拉锯”背后仍需注重再评价
国家医保局成立以来的第7次医保药品目录的现场谈判/竞价(下称“医保国谈”)已于10月30日中午落下帷幕。此次医保国谈为期3天半,共162个通用名药品参与,最终结果将在11月揭晓。
第一财经了解到,尽管此次医保国谈在谈判/竞价、续约的规则上与去年基本相同,但仍然呈现几大特点:第一,除此前已经确认简易续约的国谈品种,相当一部分为新增适应症的品种;第二,不乏有今年刚获批的创新药一上市即参与谈判,进入医保意愿强烈;第三,由于部分药品同质化竞争,前期评审的淘汰率较去年有所增加。
“下一阶段,医保国谈目录内药物的管理、使用以及上市后再评价,或将成为药企、医保部门共同发力和重点的方向。”一位药品政策与管理专家日前对第一财经表示。
数据显示,过去6年,医保国谈新增的446个药品(现阶段目录内西药和中成药的数量已增加到3088种),协议期内医保基金累计支出超3400亿元,惠及8亿人次,带动相关药品销售总额近5000亿元。目前,全国公立医院采购的药品中,目录内药品采购金额占比已超90%。
刚获上市即进“医保”
对于上述特点,前述药品政策与管理专家表示,随着医保国谈规则不断优化,药企会通过简易续约降价机制,来小幅度降价以获得更稳定的市场容量,这也使得谈判变得轻松一些。
同时,对于那些首次参与的品种,医保基金通过尽快覆盖这些品种(并以较大幅度降价)让患者受益,而药企的选择则更多地出于商业考虑,企业需要通过品种的销量攀升,来从研发的“失血”状态迅速转变成盈利的“回血”状态。
该专家还进一步称,一些准备充分的药企,由于提前预估到了在进入医保国谈后会有较大降幅,则会提前将品种价格定得略高(甚至高过发达国家的定价),随后再逐步降下来,“但对于首次参与的品种,其价格预期管理难,销量和市场规模存在不确定性,这时,谈判时医保部门和药企双方的‘拉锯’就会明显一点。”
从此次医保国谈初审情况看,目录外的独家品种包括:迪哲医药的舒沃替尼、戈利昔替尼;康方生物的依沃西单抗(2024年5月21日获批上市)、卡度尼利单抗;海思科医药的考格列汀片(2024年6月28日获批上市)、克利加巴林等。
创新药刚获批上市就进入了医保国谈序列,这体现行业怎样的发展态势?中国药科大学医药价格研究中心主任路云告诉记者,现阶段,一款创新药,从获批上市到纳入目录获得报销的时间,已从原来的5年左右降至1年多,80%以上的创新药能在上市后2年内进入医保。
路云称,以2023年国家医保目录调整为例,有多达57个品种实现“当年获批、当年纳入目录”。虽然今年的医保谈判结果还没公布,但可以看到有多个药品为了能赶上今年的国家谈判在6月30日之前压线获批,如强生的第四款多发性骨髓瘤新药CD3/BCMA双抗特立妥单抗、百奥泰的1类新药倍维巴肽等。
山西晋非投资
也有专家认为这一态势应该“辩证”看待。“作为医保基金的战略购买方,医保部门对参与谈判的创新品种始终持开放、支持和鼓励的态度,但我们仍然需要去关注当年刚获批上市的品种,它们背后的证据等级、临床表现是否充分等。”华中科技大学同济医学院药品政策与管理研究中心主任陈昊告诉记者,对于一些附条件上市的、在临床试验阶段采取了单臂试验的以及基于临床迫切需求优先审批上市的罕见病药物等,需要密切关注它们的真实世界临床证据。
在陈昊看来,证据等级不够充分的药品一旦进入医保目录,可以预见的是药品的使用人群也会急剧增长,一些在临床试验中没有暴露出来的(疗效、安全)问题也会放大。
对此,陈昊建议,医保目录调整机制应设有一套容错、衔接机制。这一机制下,医保部门得以和来自药监部门的、部分创新药上市后相关临床数据进行衔接,数据是否已经补充完毕、数据质量如何等都能成为医保部门再评价的依据。
不影响海外“定价”
医保国谈背景下,药品的价格形成也成为药企关注的重点。“定价”逻辑何在?海外“定价”是否会受到影响?
有券商研究数据显示,综合往年情况,首次入选医保国谈目录的创新药的平均降幅在40%~62%之间,绝大多数创新药实现了以量换价。以2018年、2019年两年的医保国谈品种为例,药品平均降幅分别为57%、61%,第一年销售额增幅分别为1024%、2692%。
事实上,国家医保局在今年2月5日发布一份《关于建立新上市化学药品首发价格形成机制鼓励高质量创新的通知》征求意见稿称“药品价格由市场决定”;多位受访者也对记者表示,药品的“定价”是由多种因素综合决定的,包括药品疗效、市场供需、竞争格局等,医保国谈下的调整的价格,和药品拓展海外市场时所采取的价格之间并无直接关联。
陈昊进一步表示,创新药可以基于成本、价值、目标(药品)等多种方式定价,药企在定价过程中有足够的自由定价权,同时受到国际价格体系的制约。业界议论较多的医保国谈“信封价”,其实是医保部门根据药物经济学测算、医保基金测算、国际价格比较、竞争状况分析等之后形成的价格,“因此,尽管有药企在医保国谈开始前主动选择了降价,但这一行为并不会成为该药品价格最终测算的依据。”
“药品在海外定价的过程中,药企大致可以找到一个锚定的价格,这源于药企自身的价值导向,是一种商业行为。”陈昊称,比如,美国是全球创新药价格最高的国家,该国有较强的对于创新药的支付能力和意愿,而在非洲、南美洲一些比较贫穷的地区,药企则会采取区别定价。实践中,有足够多的案例来说明创新药在海外定价的浮动性。
一位全球药品政策研究人士也认为,创新药定价或许和市场竞争更相关。该人士举例称,诺西那生钠注射液(用于治疗脊髓性肌萎缩症,SMA)在2021年医保国谈中从每针70万元降到了3.3万元,但这主要是由于罗氏制药于当年6月获批上市了一款同样针对SMA的口服药物。
路云也对记者表示,目前,暂未观察到发达国家公开明确将中国的药品价格作为本国药品定价的参考。路云解释,药企在制定海外定价策略时,需要综合考虑包括国际市场价格、不同市场的支付体系、国际定价惯例及法规等多个因素,“需要强调的是,药品的疗效、安全性、创新性才是药品价格最核心的决定性因素。”
除此之外,对于真正体现药品疗效、安全性的上市后再评价工作,多位受访者也坦言,尽管这一工作会提供更加充分的临床证据,但主要“症结”在于真实世界研究不是法定实施事项,几乎全凭药企主动发起。目前,数据、证据的信度和效度均无法得到验证。
前述药品政策与管理专家也告诉记者,目前,开展药品上市后再评价的品种比例不会超过10%,中成药、肿瘤药、精神麻醉类药等一类药物的上市后再评价工作开展尤其困难(主要在于样本人群质量参差不齐,评价设计不全面);况且,国内还没有一个专门性的机构去为药品设立上市后再评价机制,或给予一定的研究经费。
“药企一般只有在即将进行医保国谈续约,或者获得比同类竞品更强的药品优势时,才会选择开展药品上市后再评价工作。”该专家称。
仍需加大可及性
随着“双通道”管理机制、药事会等一系列做法的实施,此前业界最为关注的医保国谈药品(下称“国谈药”)在医院、定点药店的落地情况已有较大改善。
“国谈药在院内落地情况不好是个伪命题。”一位医疗机构管理者告诉记者,医院每年的用药数量有限,大约需要的品规规模在1200个至1500个,但从我们目前的医保目录来,已有3088种,数量已经非常庞大。
该管理者表示,一方面,临床医生和患者都应该有合理的期望值,该用哪些药、如何用是由临床医生专业诊断所决定的;另一方面,尽管药品进入了国家医保目录,但这并不意味着所有医院一定要去配齐,一个区域内的药品供需状态主要取决于当地的诊疗特点,甚至是医保筹资水平。
如何进一步提升国谈药在医院、药店的可及性?路云认为,在国谈药进医院时,各定点医疗机构要根据临床用药需求,及时统筹召开药事会,做到“应配尽配”;而在国谈药进药店时,各地应根据实际情况优化定点药店的布局,完善定点药店动态调整机制,这包括:加大电子处方流转的力度,充分为首次支付“双通道”药品的患者提供讲解和流程指导服务等。
上海市卫生和健康发展研究中心主任金春林也表示,对于打通国谈药落地“最后一公里”的问题,各地医保、卫健等部门已非常尽力,出台国谈药“不纳入医院药占比””不纳入医疗机构医保总额预算”等措施。
金春林称,值得注意的是,即便是国谈药已经进入医保了,但绝大多数医院对这些新药仍然缺乏足够的了解。因而,药企亟需要加大创新药在临床层面的知晓度(并非所谓的‘带金销售’),甚至加强创新药在患者层面的教育力度,多管齐下才能加快“准入”速度,毕竟国谈药的签约有一定的周期。
“进入医保的国谈药还需要做好产能供应和质量保障,如果产能存在一定问题,那么此前谈判中的报价也需要慎重。此外,贵州等西部偏远地区的药品供应链也要做好足够的物流储备。”金春林补充。